2020年8月17日,我校医学院、浙江省衰老与癌变生物学重点实验室丛羽生教授团队在Nature Cell Biology(2019年IF: 20.042)上在线发表了肿瘤抑制因子p53类泛素化修饰调控的最新研究成果“UFMylation maintains tumor suppressor p53 stability by antagonizing its ubiquitination”。该工作发现肿瘤抑制因子p53能够被UFM1共价修饰;p53的UFMylation修饰拮抗MDM2介导的p53的ubiquitination修饰及降解,维持p53的蛋白稳定性及肿瘤抑制因子的功能。

肿瘤抑制因子p53是迄今发现与人类癌症相关性最高的蛋白质,也是目前研究最多的一种抑癌基因。正常情况下,p53维持在较低表达水平,一旦细胞受到刺激和损伤,p53稳定性增强,表达水平升高,继而促进细胞周期阻滞、调节细胞自噬和细胞衰老、帮助DNA损伤修复、促进细胞代谢及细胞凋亡来抑制细胞向恶性肿瘤的转化。p53的转录激活是应急反应中关键的早期事件,多种途径能够在应急状态下激活p53,其中翻译后修饰是最主要的调控机制,包括泛素化、乙酰化、磷酸化、甲基化、类泛素化修饰SUMO和Neddylation等。p53在正常的细胞中维持极低的浓度,这主要是泛素连接酶MDM2的负反馈调节作用,MDM2在不同条件下诱使p53发生多泛素化或单泛素化,从而调节不同细胞过程中p53的定位、表达和稳定性。p53蛋白的这些修饰会因细胞受到不同的刺激而不同,这些修饰互相协作、相互影响,构成了p53调节的分子基础,赋予了p53蛋白功能的多样性,在肿瘤的发生发展中发挥着重要作用。
UFMylation修饰是最新被鉴定的一种类泛素化修饰,与泛素化修饰类似,UFM1以前体形式被合成,经过UfSP1或UfSP2剪切,形成活化的UFM1-G83后被一个特定的E1样活化酶(UBA5)激活,转移到E2样结合酶(UFC1)上,随后UFC1和E3样连接酶(UFL1,又称NLBP或RCAD)共同识别靶蛋白,对其进行Ufmylation修饰。UFM1-靶蛋白共价结合体可以被UfSP1或UfSP2剪切,释放UFM1参与新的循环(图1)。UFMylation修饰的缺陷导致小鼠胚胎致死及多种人类重大疾病,说明UFMylation修饰具有极其重要的生物学功能。然而其修饰的底物、修饰的调控机制、及其调控的生物学过程目前仍不清晰。
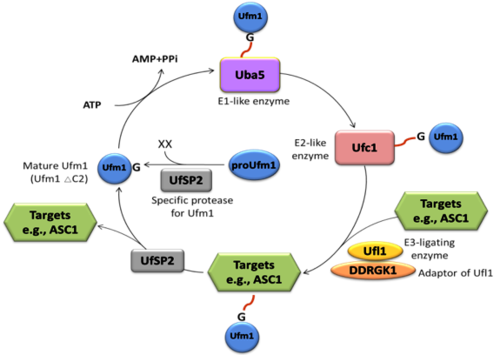
图1. Ufmylation修饰系统示意图
丛羽生教授团队研究发现肿瘤抑制因子p53和UFMylation修饰的E3样连接酶UFL1以及UFMylation修饰调节因子DDRGK1存在直接相互作用,并在体内和体外验证了p53能够被UFM1共价修饰;p53的UFMylation修饰能够拮抗MDM2介导的p53的ubiquitination修饰及降解;p53的UFMylation修饰维持了p53的蛋白稳定性及肿瘤抑制因子的功能(图2)。
图2. Ufmylation修饰和Ubiquitination修饰互作调控p53蛋白稳定性。
丛羽生教授团队的研究工作阐明了p53蛋白UFMylation修饰的分子调控机制,明确了UFMylation修饰对p53生物学功能的影响,不仅揭示了p53蛋白UFMylation修饰在肿瘤发生中的重要作用,而且为探讨细胞生命活动提供新的视野,为癌症的防治提供新的思路和策略。刘江副教授和管娣副教授为该论文的共同第一作者。该项研究得到了国家自然科学基金重点项目、面上项目、青年基金以及浙江省自然科学基金等项目的支持。
原文转载链接:https://www.hznu.edu.cn/c/2020-08-20/2442505.shtml
版权所有 © 2020 杭州师范大学 浙江省衰老与癌变生物学重点实验室 公安备案号:33011002011919 浙ICP备11056902号-1